Современное лечение цирроза печени
| Современные методы диагностики и лечения цирроза печени Современные методы лечения цирроза печени ЦИРРОЗЫ ПЕЧЕНИ Цирроз печени — диффузный процесс, характеризующийся фиброзом и перестройкой нормальной архитектоники печени, приводящий к образованию структурно аномальных узлов. Этиология. Вирусные гепатиты В, С, D, хронический алкоголизм, аутоиммунные гепатиты, гемохроматоз, болезнь Вильсона — Коновалова, различные состояния, связанные с недостаточностью a1-антитрипсина; паразитарные заболевания (шистозоматоз) внутри- и внепеченочных желчных путей, обструкция венозного оттока при болезни и синдроме Бадда-Киари и правожелудочковой СН. В случае невыясненной этиологии говорят о криптогенных циррозах. Патогенез близок к механизму развития ХГ. Цирроз определяется возникающим механизмом самопрогрессирования — образующейся рубцовой тканью, нарушением нормальной регенерации гепатоцитов с образованием узлов, появлением новых сосудистых анастомозов между воротной веной, почечной артерией и печеночной веной, приводящих к сдавлению и ишемии участков здоровой ткани, вплоть до ишемического некроза ее. Формирование цирроза печени происходит в течение многих месяцев или лет. За это время меняется генный аппарат гепатоцитов и создаются поколения патологически измененных клеток. Этот процесс в печени можно охарактеризовать как иммуновоспалительный. Важнейший фактор в генезе алкогольного цирроза печени — повреждение (некроз) гепатоцитов, обусловленный прямым токсическим действием алкоголя, а также аутоиммунными процессами. Сенсибилизация иммуноцитов к собственным тканям организма — важный фактор патогенеза и при циррозе, развивающемся у больных вирусными гепатитами В, С и D. Основной мишенью аутоиммунной реакции представляется здесь печеночный липопротеид. Доминирующий фактор патогенеза застойного цирроза печени — некроз гепатоцитов, связанный с гипоксией и венозным застоем. Дальнейший этап развития патологического процесса: формируется портальная гипертензия — повышение давления в системе портальной вены, обусловленное обструкцией внутри- или внепеченочных портальных сосудов. Портальная гипертензия, в свою очередь, приводит к появлению портокавального шунтирования кровотока, спленомегалии и асцита. Со спленомегалией связаны тромбоцитопения (усиленное депонирование кровяных пластинок в селезенке), лейкопения, анемия (повышенный гемолиз эритроцитов). Асцит приводит к ограничению подвижности диафрагмы (риск легочных ателектазов, пневмоний), гастроэзофагальному рефлюксу с пептическими эрозиями, язвами и кровотечениями из варикозно расширенных вен пищевода, брюшным грыжам, бактериальному перитониту, гепаторенальному синдрому. У больных циррозом печени часто наблюдаются гепатогенные энцефалопатии. Классификация: по морфологическому, этиологическому и клинико-функциональному признакам. 1. Циррозы, различающиеся по морфологическому признаку: портальный (селтальный); постнекротический; билиарный: а) с внепеченочной обтурацией; б) без внепеченочной обтурации; смешанный. 2. Циррозы, различающиеся по этиологическому признаку: инфекционный (преимущественно вирусной природы); обменный (за счет наследственных ферментопатий — галактоземия, гликогенная болезнь, гепатолентикулярная дегеренация, гипербилирубинемия Криглера—Найяра и др.); вследствие врожденной аномалии желчных путей; токсико-аллергические, инфекционно-аллергическис и др. Предполагается учитывать также: наличие печеночной недостаточности (есть, нет); состояние портального кровотока (портальная гипертензия есть, нет); гиперспленизм (есть, нет). Морфологические изменения. Мелкоузловой (портальный) цирроз — это цирротически трансформированная печень, в которой почти все узлы имеют диаметр менее 3 мм. Поразительным свойством узлов является постоянство их размера. Мелкие узлы редко содержат портальные тракты, но обычно структура их уже аномальна. Крупноузловой (постнекротический) цирроз. При данной форме диаметр многих узлов составляет более 3 мм, однако эта величина может значительно варьировать, и размер некоторых узлов достигает нескольких сантиметров. В них могут содержаться портальные структуры и эфферентные вены, но их расположение относительно друг друга аномально. Между крупными узлами могут быть тонкие, иногда неполные перегородки, которые связывают участки портального тракта. Эту форму называют «неполной септальной» или «постгепатитной». Иногда изменения ткани более выражены, выглядят как рубцы, четко различимы крупные узлы, окруженные широкой фиброзной перегородкой. Такая форма — результат некроза («следствие коллапса» или «постнекротическая»). При ней число мелких и крупных узлов примерно одинаково. Печень при портальном циррозе часто имеет нормальные размеры или увеличена, особенно при ожирении. Размер печени при постнекротическом циррозе может быть нормальным, но часто бывает уменьшенным, особенно при наличии грубых рубцов. Клинические проявления Выделяют несколько синдромов. Болевой синдром связан с дискинезией желчных путей или с некротическими изменениями в печени (особенно подкапсульными). Синдром желтухи обусловлен либо механическим нарушением оттока желчи вследствие внутрипеченочного холестаза, либо некротическими изменениями и всасыванием связанного билирубина в кровь. Характерны синдром гепатомегалии; синдром портальной гипертензии (см. выше). Последний проявляется варикозным расширением вен в пищеводе, прямой кишке и на передней брюшной стенке; асцитом и спленомегалией. Спленомегалия может сопровождаться гиперспленизмом, проявляющимся лейкопенией, тромбоцитопенией и в тяжелых случаях — анемией. Гепатопанкреатинеский синдром — снижение функции поджелудочной железы, приводящее к нарушению нормального пищеварения. Изменения в ССС — гипотензия и тахикардия. Лабораторные данные характеризуют активность процесса и функциональное состояние печени, как и при других ее заболеваниях, однако у больных циррозом печени они бывают малоинформативными. Для цирроза печени характерны необратимый характер течения процесса, уплотнение печени, а также неровность ее поверхности. При вирусном циррозе возможно на протяжении ряда лет латентное течение. Обострения не столь остры, более значительны спленомегалия и диспротеинемия. Не исключено фулминантное (молниеносное) течение с тяжелой паренхиматозной желтухой. Холестатический вариант цирроза с высокой активностью ферментов характеризуется неуклонным прогрессированием, невозможностью обратного развития. Такие циррозы плохо поддаются лекарственной терапии. Цирроз печени как исход аутоиммунного (люпоидного) гепатита чаще наблюдается у молодых женщин. Интересен факт обнаружения у этих больных генотипов HLA-B5 и HLA-BW54, высокая активность цитолитических ферментов, выраженные некротические изменения в ткани печени, часта паренхиматозная желтуха. Такие формы цирроза почти не дают ремиссии, отчетливы и значительны системные проявления. У 50% больных алкогольным циррозом самочувствие в течение долгого времени остается хорошим. На определенном этапе развиваются все признаки алкогольной болезни — от локально печеночных до поражения ЖКТ, нервной системы. Заслуживают особого внимания поздние клинические симптомы вовлечения печени: телеангиоэктазии, пальмарная эритема (покраснение выпуклой части ладони), побледнение ногтей, развитие «барабанных палочек», проявления геморрагического диатеза. Характерен внешний вид больного: цвет кожи всегда грязно-серый, темный. Возможны разнообразные эндокринные расстройства. Диагностика. Гепатомегалия при отсутствии декомпенсации сердечной деятельности и очевидных других заболеваний предполагает хронический гепатит, а при увеличенной, да еще и плотной печени — цирроз. Если же в таком случае имеются признаки портальной гипертензии (асцит, варикоз вен), то диагноз цирроза может быть установлен окончательно. Нужно иметь в виду, что причиной увеличения печени могут быть цирроз-рак и метастазы рака, но частота этих поражений не столь велика. Другими признаками цирроза являются потеря аппетита, появление желтухи, зуда (вызванного поступлением желчных кислот в кожу), общая слабость, покраснение ладоней, телеангиоэктазии, гипертрофия околоушной железы, гинекомастия или фиброз сухожилий ладоней. При выявлении увеличенной печени необходимо провести тщательное биохимическое исследование: белково-осадочные пробы, активность аминотрансфераз, ЛДГ и ЩФ, УЗИ и радионуклидное сканирование печени. При активно текущем воспалительном процессе у больных циррозом печени повышено содержание в крови печеночных энзимов (АлАТ, АсАТ, ЩФ, ГГТП), билирубина, у-глобулинов; снижены содержание альбумина, активность холинэстеразы, факторов коагуляции (протромбиновое время). Нарушен нормальный метаболизм триглицеридов, холестерина и сахара. Цирроз может приводить к инсулинорезистентности и СД. Печеночно-клеточная функция при циррозе оценивается по критериям Чайлд—Пью. Показатели группы А соответствуют компенсированному циррозу, В — субкомпенсированному, С — декомпилированному. Классификация степени тяжести цирроза печени по Чайлд-Пью 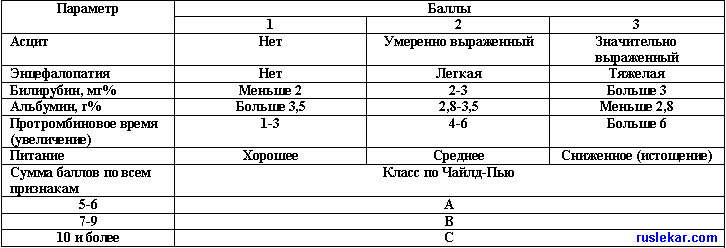 Характерны системность поражения, артралгии, лихорадка, сочетающиеся с отчетливым диспепсическим синдромом, что подтверждает мысль о заболевании печени. Очень важным в диагностике цирроза является учет факторов риска: острый вирусный гепатит в анамнезе, контакт с больными вирусным гепатитом; лица, подвергшиеся переливанию крови, оперативным вмешательствам, злоупотребляющие алкоголем, вирусоносители HBsAg. Наиболее надежным способом установления степени активности остается морфологический. Морфологически активность определяется степенью деструкции печеночных клеток и воспалительной инфильтрацией, частичным некрозом краев перегородок, наличием ацидофильных телец, очаговых некрозов. Течение и прогноз. Выживаемость при описанных формах цирроза — 16% за 3 года и 8% за 5 лет. Существенно сокращают период оставшейся жизни осложнения цирроза: так, после появления асцита, пищеводного кровотечения или желтухи 5-летняя выживаемость — не более 5%. Наличие и выраженность симптомов печеночной недостаточности более точно определяют прогноз. У 3—4% больных циррозом ежегодно формируется печеночно-клеточная карцинома. Осложнения циррозов печени: кровотечения из ЖКТ, сидероз, холестаз, риск инфицирования вирусами и бактериями. Лечение. Лечение цирроза носит поддерживающий характер и подразумевает устранение повреждающего воздействия, усиленное питание (включая дополнительный прием витаминов) и борьбу с осложнениями, если они возникают. Из препаратов специфического действия, прием которых при циррозе способен снизить скорость фиброзного перерождения печени, с разной степенью успешности могут применяться ГКС (преднизолон, метипред, триамцинолон), снижающие уровни РНК, необходимой для синтеза коллагена, и обладающие противовоспалительным действием. D-пеницилламин (купренил) препятствует образованию поперечных сшивок в молекуле коллагена, гамма-интерферон, кроме противовирусного действия, уменьшает продукцию коллагена. Применение иммунодепрессантов (азатиоприна) приносит некоторую пользу, особенно при поражениях печени, вызванных действием аутоиммунных механизмов повреждения клеток. Согласно «Стандартам диагностики и лечения...»: Цирроз печени компенсированный (класс А по Чайлд — Пью — 5—6 баллов: билирубин — <2 мг%, альбумин >3,5 г%, протромбиновый индекс 60—80, отсутствуют печеночная энцефалопатия и асцит). При компенсированном циррозе лечение гепатита С бесспорно показано. Базисная терапия и устранение симптомов диспепсии — панкреатин (креон, панцитрат, мезим и другие аналоги) 3—4 раза в день перед едой по одной дозе, курс — 2—3 нед. Цирроз печени субкомпенсированный (класс В по Чайлд—Пью — 7—9 баллов: билирубин 2-3 мг%, альбумин 2,8-3,4 г%, протромбиновый индекс 40-59, печеночная энцефалопатия I—II ст., асцит небольшой транзиторный). Диета с ограничением белка (0,5 г/кг) и поваренной соли (менее 2,0 г/сут). Спиронолактон (верошпирон) внутрь 100 мг в день постоянно; фуросемид 40—80 мг в нед постоянно и по показаниям; лактулоза (нормазе) 60 мл/сут (в среднем) постоянно и по показаниям; неомицин сульфат или ампициллин 0,5 г 4 раза вдень. Курс 5 дней каждые 2 мес. Цирроз печени декомпенсированный (класс С по Чайлд—Пью — более 9 баллов: билирубин > 3 мг%, альбумин 2,7 г% и менее, протромбиновый индекс 39 и менее, печеночная энцефалопатия III-IV ст., большой торпидный асцит). Лечение гепатита С при декомпенсированном циррозе опасно из-за большой вероятности угрожающих жизни инфекционных осложнений. Кроме того, лечение может ускорить развитие печеночной недостаточности, как это происходит при использовании интерферона у больных гепатитом В с декомпенсированным циррозом печени. Десятидневный курс интенсивной терапии: терапевтический парацентез с однократным выведением асцитической жидкости и одновременным в/в введением 10 г альбумина на 1,0 л удаленной асцитической жидкости и 150—200 мл полиглюкина; клизмы с сульфатом магния (15—20 г на 100 мл воды), если имеются запоры или данные о предшествующем пишеводно-желудочно-кишечном кровотечении; неомицин сульфат 1,0 г или ампициллин 1,0 г 4 раза в сут (курс 5 дней); внутрь или через назо-гастральный зонд лактулозу 60 мл/сут (курс 10 дней); в/в капельное введение 500-1000 мл/сут гепастерила-А (курс - 5-7 инфузий). Курс пролонгированной постоянной терапии: базисная терапия с устранением симптомов диспепсии (полиферментный препарат перед едой постоянно); спиронолактон (верошпирон) внутрь 100 мг в день постоянно, фуросемид 40—80 мг/нед; постоянно внутрь лактулозу (нормазе) 60 мл/сут (в среднем), постоянно неомицин сульфат или ампициллин 0,5 г 4 раза в день. Курс 5 дней каждые 2 мес. Базисная терапия, включая диету, режим и лекарства, предписывается пожизненно, а интенсивная терапия — на период декомпенсации и в связи с осложнениями — симптоматическое лечение. Кровотечение из варикозных вен пишевода останавливается эндоскопической склеротерапией или перевязкой резиновой лентой. Разрывы могут предотвращаться введением некоторых препаратов (например, b-адреноблокаторов). Для профилактики гематологических осложнений, несмотря на недостаточную обоснованность такого подхода, стали все шире использовать колониестимулирующие факторы — эритропоэтин (эпоэтин), ГКСФ (филграстим) и ГМКСФ (молграстим). Применение эритропоэтина при угрозе анемии у больных, получающих рибавирин, представляется целесообразным, однако о влиянии эритропоэтина на эффективность противовирусного лечения ничего не известно. При декомпенсированном циррозе печени, признаком которого служит хотя бы одно из следующих осложнений — асцит, энцефалопатия, недостаточность синтетической функции печени и кровотечения из варикозных вен пищевода вследствие портальной гипертензии — методом выбора служит трансплантация печени. Трансплантат, как правило, тоже инфицируется вирусом гепатита С; часто наблюдается прогрессирующий посттрансплантационный гепатит. Устранение виремии до трансплантации снижает вероятность постгрансплантационной инфекции, следовательно, лечение гепатита С у кандидатов на трансплантацию при приемлемом риске вполне оправданно. Как и у больных гепатитом В с циррозом печени, устранение виремии в предтрансплантационном периоде может замедлить прогрессирование цирроза и даже уменьшить его тяжесть. Особенности лечения некоторых форм цирроза печени. Цирроз печени, развившийся в исходе аутоиммунного гепатита, преднизолон 5—10 мг/сут — постоянная поддерживающая доза: азатиоприн 25 мг/сут (при отсутствии противопоказаний — гранулопитопении и тромбоцитопении). Цирроз печени, развившийся и прогрессирующий на фоне хронического активного вирусного гепатита В или С В случае цирроза, развившегося из гепатита В, целесообразен прием ламивудина, даже в тяжелых случаях. Ламивудин (антиретровирусное средство — нуклеозидный ингибитор обратной транскриптазы) принимается внутрь в таблетках, покрытых оболочкой в дозе 15G мг 2 раза в сут. При циррозах, развившихся из гепатита С. Прием интерферона (или интерферон + рибавирин — см. «лечение гепатита») может приводить к снижению воспаления, фиброза и, возможно, к снижению риска развития ГЦК. Сегодня при выборе интерферона предпочтение следует отдавать пегинтерферону. Названные препараты не могут прописываться больным в поздней стадии цирроза по причине наличия у них побочных эффектов. В случае алкогольных форм цирроза категорически запрещается прием спиртных напитков. Лечение аналогично таковому при алкогольном гепатите (см. «лечение алкогольного гепатита»). ПЕРВИЧНЫЙ БИЛИАРНЫЙ ЦИРРОЗ ПЕЧЕНИ Первичный билиарный цирроз (ПБЦ) — хроническое прогрессирующее гранулематозное деструктивное воспалительное заболевание междольковых и селтальных желчных протоков аутоиммунной природы, приводящее к развитию длительного холестаза, а на поздних стадиях к формированию цирроза. ПБЦ болеют преимущественно женщины среднего возраста независимо от расовой принадлежности. В структуре мировой смертности от всех циррозов печени доля ПБЦ составляет почти 2%. Заболевание встречается с частотой 19—151 случай на 1 млн населения. Вероятность заболевания в семьях, где имеется больной ПБЦ, в 1000 раз больше, чем в общей популяции. Так как тема очень запутанная и, судя по трудностям, которые возникают у студентов при ее освещении, так ими и не освоенная, приведем сравнительные характеристики ПБЦ и ПСХ. Этиология окончательно не установлена. Большое значение придается генетической предрасположенности и нарушению иммунных механизмов. В подтверждение фамильного (генетического) наследования приводятся данные о выявлении антимитохондриальных антител (АМА) у 7% родственников больных (0,4% в популяции) ПБЦ. Есть основание говорить об индуцированной вирусом деструкции гепатоцитов и желчных протоков. Закономерна связь ПБЦ с избыточным накоплением меди, кальцинозом, феноменом Рейно, склеродактилией, телеангиоэктазиями. Сухость слизистых оболочек, аутоиммунный тиреоидит и почечный канальцевый ацидоз говорят о системном характере процесса. Триггерными факторами иммунопатологической реакции могут служить вирусные (гепатотропные вирусы), бактериальные (энтеробактерии, хеликобактер) и другие антигены. Патогенез. Формирование билиарных циррозов связано с внутрипеченочным холестазом, обусловленным задержкой желчи в пределах желчных капилляров портальных трактов. Особенностью внутрипеченочного холестаза, прежде всего его начальных этапов, является преимущественная задержка желчных кислот, а не билирубина. Накопление желчных кислот сопровождается гиперхолестеринемией и отложением меланина в коже. Центральной мишенью для развития воспалительной реакции и иммунного ответа являются желчные протоки. АМА связываются с апикальной мембраной эпителиальных клеток желчных протоков, на поверхности которых находятся белки главного комплекса гистосовместимости (МНС) класса И. Можно предположить, что патологическая экспрессия аутоантигена происходит раньше, чем формируется иммунный ответ с экспрессией на поверхности клеток белков класса II. Дальнейшая экспрессия происходит на поздних стадиях развития заболевания, наличие активированных Т-клеток связано с протекающим некровоспалительным процессом в желчных протоках Основную роль в непосредственном повреждении внутрилеченочных желчных протоков играют Т-лимфоциты Морфологические изменения. Выделяют четыре морфологические стадии ПБЦ: 1) хронический негнойный деструктивный холангит, портальный гепатит; 2) пролиферация желчных канальцев, перипортальный гепатит; 3) склерозирование, мостовидные некрозы, септальный фиброз; 4) цирроз печени. Характерно увеличение содержания желчного пигмента в гепатоцитах, главным образом у билиарного полюса, крупных гранул в желчных протоках и по мере прогрессирования заболевания появление желчных пробок. В гепатоцитах — скопление жира с развитием жировой дегенерации. Имеют место регенерация, фибропластические реакции, разрастание коллагена по портальным трактам, утолщение портальных трактов, их деформация, склероз. Клинические проявления. Ведущим симптомом является желтуха, обнаруживаемая у 80% больных, которая может то нарастать, то уменьшаться. Цвет кожи при этом из разных оттенков желтого цвета становится грязновато-серым. Характерен выраженный диффузный кожный зуд. Печень, как правило, увеличена, причем значительно, селезенка также увеличена. По мере прогрессирования цирроза печень начинает уменьшаться. Нарушение метаболизма кальция приводит к поражению отдельных трубчатых костей, позвоночника, болевым ощущениям по ходу костей. Портальная гипертензия возникает довольно поздно. Особенностью портального блока при этом заболевании является его пресинусоидальный характер. Для билиарного цирроза закономерна системность поражений, наиболее ярко проявляющаяся изменением экзокринных желез: слезных, слюнных, поджелудочной железы, а также почек (тубулоинтерстициальный нефрит, гломерулонефрит) и сосудов (васкулит) различных органов. Синдром Шегрена при целенаправленном обследовании выявляют у 70—100% больных билиарным циррозом. Вовлечение слезных и слюнных желез при синдроме Шегрена наиболее часто клинически проявляется сухим кератоконъюнктивитом, ксеростомией, снижением слезоотделения при пробе Ширмера, рецидивирующим паротитом и сухостью кожи. РА обнаруживается у 4% больных. Легочный синдром, наблюдающийся у больных билиарным циррозом, скорее рентгенологический, чем клинический, и характеризуется картиной диффузного пневмосклероза с деформацией легочного рисунка из-за дополнительных тяжистых, петлистых и ячеистых тканей по интерстици- альному типу и фиброзируюшего альвеолита. Прогрессирование ПБЦ зависит от степени холестаза. Отсутствует параллелизм между выраженностью клинических проявлений и быстротой прогрессирования цирроза. Тяжесть заболевания коррелирует с уровнем гипербилирубинемии и выраженностью портальной гипертензии. Средняя продолжительность жизни больных с момента диагностирования портальной гипертензии составляет 5,5 лет. При медленно прогрессирующем ПБЦ могут развиться гепатоцеллюлярная гепатома, рак печени. Диагностика Лабораторные данные. Выявляются характерные биохимические отклонения: значительное повышение активности ЩФ, ГГТП, умеренное (в 3—5 раз) повышение активности трансаминаз (АлAT, AcAT), различной степени выраженности повышение билирубина. У всех больных ПБЦ изменены показатели липидного спектра. На ранних стадиях ПБЦ обнаружено значительное повышение уровня общего холестерина, отмечена тенденция к увеличению фракций фосфолипидов, а также значительное повышение содержания ЛПВП и ЛПНП, В биоптатах больных ПБЦ на ранних стадиях общее количество фосфолипидов превышает нормальные величины в 1,5 раза, что связано с увеличением содержания лецитина в клеточных мембранах. При исследовании гуморального иммунитета у больных ПБЦ в подавляющем большинстве случаев характерно значительное повышение уровня IgM (содержание его достигает в среднем 6,27±0,66 г/л). Особое значение в диагностике ПБЦ придается АМА. В настоящее время известны антитела к 9 антигенам внутренней и внешней митохондриальной мембраны. Из них с ПБЦ связаны антиМ2, М4, М8, М9. Остальные антитела ассоциированы с другими заболеваниями: антиМ1 — с сифилисом, антиМ5 — с заболеваниями соединительной ткани, антиМЗ — с лекарственным гепатитом, антиМ7 — с миокардитом. Антитела к антигену внутренней мембраны митохондрий М2 обнаруживают почти во всех случаях ПБЦ и считают патогномоничными для этого заболевания. АМА к М4 выявляют при заболевании с чертами как ПБЦ, так и аутоиммунного гепатита (overlapsyndrome), к М8 при быстропрогрессирующей форме ПБЦ, к М9 на ранних стадиях ПБЦ. Титр антимитохондриальных антител часто коррелирует с активностью ПБЦ. АМА могут обнаруживаться на доклинической стадии и не исчезают на протяжении всего периода болезни. Инструментальные методы Дополнительные методы исследования используют для исключения обструкции желчных протоков. Ультразвуковое исследование (УЗИ) — неинвазивный метод, обычно достаточный для исключения обструкции желчных протоков. Компьютерную томографию применяют в тех случаях, когда УЗИ технически невыполнимо. Используют чрескожную и эндоскопическую ретроградную холангиографию, выявляющую при ПБЦ обеднение рисунка и сужение желчных протоков, нарушение прохождения контрастирующего вещества. Пункционная биопсия печени имеет большое значение в диагностике ПБЦ, особенно на бессимптомной и ранних стадиях заболевания. На стадии цирроза печени морфологические изменения становятся менее специфичными. При 1—2-й стадии ПБЦ в биоптатах выявляют различную степень повреждения желчных канальцев. Наиболее ранними изменениями следует считать дистрофию клеток эпителия желчных протоков. Далее формируется картина деструктивного негнойного холангита, образование гранулем. Прогрессирование ПБЦ в значительной мере обусловлено выраженностью разрушения внутрипеченочных желчных протоков. При стадиях 2-3 в биоптате обнаруживают пролиферацию дуктул, Фиброзы и перинодулярный фиброз, склероз с образованием слепых септ. Для 4-й стадии ПБЦ характерна картина выраженного мелкоузлового цирроза, наряду с признаками, присущими более ранним проявлениям болезни. Диагностические критерии ПБЦ: 1.Интенсивный кожный зуд, клиническое подозрение на основании наличия внепеченочных проявлений (сухой синдром, ревматоидный артрит и др.). 2. Повышение уровня ферментов холестаза в 2—3 раза по сравнению с нормой. 3. Нормальные внепеченочные желчные ходы при УЗИ. 4. Обнаружение антимитохондриальных антител в титре выше 1:40. 5. Повышение уровня IgM в сыворотке крови. 6. Характерные изменения в пунктате печени. Диагноз ПБЦ ставят при наличии 4-го и 6-го критериев или 3—4 указанных признаков. Лечение Целью проводимой патогенетической терапии является замедление прогрессирования заболевания, улучшение качества жизни больных ПБЦ и увеличение ее продолжительности. Длительный эффект различных лекарственных средств при ПБЦ пока не установлен. Отдельную проблему представляет дефицит солей желчных кислот в просвете кишечника. Диетические рекомендации включают адекватный прием белка и поддержание необходимой калорийности пищи. При наличии стеатореи прием нейтральных жиров, которые плохо переносятся, недостаточно всасываются и ухудшают всасывание кальция, ограничивают до 40 г/сут. Дополнительным источником жиров могут служить триглицериды со средней длиной цепи (ТСЦ) в виде эмульсии (например, молочного коктейля). ТСЦ перевариваются и всасываются в виде свободных жирных кислот даже при отсутствии желчных кислот в просвете кишечника. Значительное количество ТСЦ содержится в кокосовом масле для жарки и салатов. Необходим также дополнительный прием кальция. Наиболее эффективным признано применение урсодезоксихолевой кислоты (УДХК). УДХК - третичная желчная кислота, образующаяся в гепатоцитах, является гидрофильной и нетоксичной. УДХК подавляет секрецию токсичных желчных кислот в желчь, всасывание их в подвздошной кишке и тем самым способствует их выведению из организма (антихолестатическое действие); вследствие своей гидрофильности УДХК улучшает текучесть фосфолипидного бислоя мембраны гепатоцитов, восстанавливает структуру клеток и защищает их от повреждений (цитопротективное действие); снижает синтез иммунокомпетентного IgM (в меньшей степени IgG и IgA), на гепатоцитах и холангиоцитах уменьшается экспрессия антигенов гистосовместимости, что в свою очередь предотвращает активацию цитотоксических Т-лимфоцитов, а также уменьшает продукцию аутоантител и способствует снижению иммунопатологических реакций; подавляет синтез холестерина в печени, уменьшая его секрецию в желчь и всасывание в кишечнике. Применение УДХК в дозе 13—15 мг на 1 кг массы тела в течение 3 мес и более приводит на ранних стадиях заболевания к отчетливому клиническому улучшению и положительной динамике лабораторных параметров. Влияние данного препарата на гистологические изменения также благоприятно. Применение УДХК улучшает качество жизни больных ПБЦ, что выражается в первую очередь снижением интенсивности кожного зуда. Назначение преднизолона в дозе 30 мг в день в течение 8 нед с постепенным уменьшением дозы до 10 мг/день имеют потенциальную ценность для терапии ПБЦ, однако сопутствующие побочные эффекты заставляют считать их опасными веществами и длительно не назначать при ПБЦ. Риск развития тяжелого остеопороза может быть снижен при комбинации ГКС с бифосфонатами. Будезонид представляет ГКС второго поколения с низкой системной активностью, практически не вызывающей побочных эффектов. Проводится изучение эффективности препарата у больных ПБЦ. Есть основания надеяться, что этот препарат сможет обеспечить все преимущества ГКС, не подвергая дополнительному риску жизнь пациентов. Для противодействия иммунным нарушениям используют цитостатики: азатиоприн, имуран (1 мг/кг-сут), хлорамбуцил (0,5—4 мг/кг-сут), циклоспорин А (10 мг/кг-сут), однако ввиду отсутствия отчетливого эффекта на прогрессирование заболевания и наличие серьезных осложнений они не могут быть рекомендованы для регулярного использования при ПБЦ. D-пеницилламин способствует элиминации избытка меди из печени и подавляет иммунные реакции. Дозы — по 150 мг 1—3 раза в неделю в течение 2—5 нед с возможным поддерживающим курсом. Для борьбы с зудом используют: фенобарбитал (на ночь 80—120 мг); андрогенные стероиды (метилтестостерон — 10—15 мг/сут, метандростенолон); ультрафиолетовое облучение кожи по 9—12 мин в день; плазмаферез. Вводят парентерально жирорастворимые витамины: К — 10 мг п/к каждые 4 нед, D — 100000 ЕД в/м каждые 4 нед, А — 25 000 ЕД внутрь ежедневно, препараты кальция до 1 г ежедневно. Чаше других применяют холестирамин. При применении этой ионообменной смолы у больных с частичной билиарной обструкцией зуд исчезает через 4—5 сут. Предполагается, что холестирамин уменьшает зуд, связывая соли желчных кислот в просвете кишечника и удаляя их с калом, однако данный механизм действия является лишь предположительным, так как причина зуда при холестазе остается неясной. При приеме холестирамина в дозе 4 г (1 пакетик) до и после завтрака появление препарата в ДПК совпадает с сокращениями желчного пузыря. При необходимости возможно дальнейшее увеличение дозы (по 4 г перед обедом и ужином). Поддерживающая доза составляет обычно 12 г/сут. Препарат может вызывать тошноту и отвращение к нему. Применение препарата особенно эффективно для борьбы с зудом у больных с ПБЦ, ПСХ, атрезией и стриктурами желчных протоков. Отмечается снижение уровня желчных кислот и холестерина в сыворотке, уменьшение или исчезновение ксантом. Холестирамин повышает содержание жира в кале даже у здоровых людей. Необходимо использовать препарат в минимальных эффективных дозах. Возможно развитие гипопротромбинемии вследствие ухудшения всасывания витамина К, что является показанием к его в/м введению. Холестирамин может связывать кальций, другие жирорастворимые витамины и лекарства, участвующие в энтерогепатической циркуляции, особенно дигитоксин. Холестирамин и другие препараты должны приниматься раздельно. Антибиотик рифампицин способен повышать активность микросомальных ферментов печени, что может помочь в борьбе с зудом. Этот эффект объясняют нормализацией гидроксилирующей активности цитохрома Р-450. При несокрушимом зуде в последние годы стали длительно назначать урсодиол до 4 лет в дозе 13-15 мг/кг-сут. Одновременно снижается активность ЩФ и аминотрансфераз. Наиболее эффективным и перспективным способом лечения ПБЦ на поздних стадиях считается трансплантация печени, при которой выживаемость в течение 1 года составляет 60—70%. ВТОРИЧНЫЙ БИЛИАРНЫЙ ЦИРРОЗ ПЕЧЕНИ Вторичный билиарный цироз печени - современное название - первичный склерозирующий холангит (ПСХ). Этиология ПСХ неизвестна. Все участки билиарного дерева могут вовлекаться в хронический воспалительный процесс с развитием фиброза, приводящего к облитерации желчных путей и в итоге — к билиарному циррозу. Заболевание может ограничинаться внутри- или внепеченочными желчными протоками. Со временем междольковые, септальные и сегментарные желчные протоки замещаются фиброзными тяжами. Воспаление мельчайших протоков портальных трактов называют перихолангитом либо ПСХ мелких протоков. Почти у 70% больных ПСХ имеется сопутствующий НЯК; очень редко — регионарный илеит. ПСХ и НЯК в редких случаях могут быть семейными. Более чувствительны к ним лица с гаплотипами Al, B8, DR3, DR4 и DRW5 системы HLA При гепатите у лиц с гаплотипом DR4 заболевание, по-видимому, прогрессирует быстрее. Патогенез. Имеются признаки нарушения иммунной регуляции. Циркулирующие AT к компонентам тканей не выявляются или выявляются в низком титре. По крайней мере, в 2/3 случаев обнаруживаются перинуклеарные антинейтрофильные цитоплазматические AT. Вероятно, эти AT не участвуют в формировании патологического процесса, а являются эпифеноменом. Кроме того, в сыворотке выявляются аутоантитела к перекрестно реагирующему пептиду, вырабатываемому эпителием толстой кишки и желчных путей. ПСХ может сочетаться с другими аутоиммунными заболеваниями, в том числе с тиреоидитом и СД I типа. Имеет место развитие холестаза, перилобулярного фиброза и цирроза. Для более крупных желчных ходов характерна гипертензия. В портальных трактах, внутридольковой строме формируется вторичный холангиогепатит. Для ПСХ характерно расширение извилистых желчных протоков, утолщение их стенок, периваскулярное воспаление. Значительное повышение давления в протоках приводит к развитию некротических изменений в печеночной клетке. При этом избыток билирубина оказывает тяжелое токсическое действие. При ПСХ некрозы более распространенные и тяжелые в сравнении с ПБЦ. Описываются желчные инфаркты печени. При полной обтурации желчных протоков цирроз может не успеть сформироваться. Развивается ОПечН, приводящая больных к гибели. Поэтому обтурация, хотя и является условием возникновения цирроза, должна быть неполной. Существует определенный критический уровень повышения давления в желчных протоках и их блокады. Морфологические изменения У всех больных ПСХ имеются изменения гистологической картины печени. Главные из них: воспаление желчных протоков с их облитерацией, перидуктальный фиброз, пролиферация желчных протоков, дуктопения и холестаз. Фиброз по времени возникновения и массивности опережает таковой при ПБЦ. Клинические проявления. Мужчины болеют в 2 раза чаще, чем женщины. Заболевание обычно развивается в возрасте 25—45 лет, но возможно даже у детей 2 лет, обычно в сочетании с хроническим НЯК. Чаще начало заболевания бессимптомное. Первым проявлением, особенно при скрининговом обследовании больных с НЯК, оказывается повышение активности ЩФ сыворотки. Тем не менее ПСХ может выявляться холангиографически даже при нормальной активности ЩФ. Заболевание может дебютировать повышением активности сывороточных трансаминаз. Именно на основании этих признаков ПСХ может быть случайно выявлен у доноров при сдаче крови. Даже при бессимптомном течении заболевание может прогрессировать с развитием цирроза печени и портальной гипертензии, обычно пресинусои- дальной, без признаков холангита или холестаза. Такие больные могут много лет лечиться от «криптогенного» цирроза. Обычно в начале ПСХ наблюдаются уменьшение массы тела, утомляемость, зуд, боль в правом верхнем квадранте живота, преходящая желтуха. Наличие этих симптомов свидетельствует о далеко зашедшем процессе. Лихорадка нехарактерна, если только вследствие операций на желчных путях или эндоскопического обследования не разовьется восходящий холангит. Тем не менее иногда заболевание начинается с лихорадки, озноба, боли в правом верхнем квадранте живота, зуда и желтухи, напоминая острый бактериальный холангит. Посев крови редко дает положительные результаты, антибиотики неэффективны. Осложнения, связанные с ПСХ: печеночные абсцессы, пилефлебиты. Портальная гипертензия возникает довольно поздно, поэтому кровотечения развиваются сравнительно редко. Диагностика Отличить ПСХ от ПБЦ позволяют результаты холангиографии и отсутствие антимитохондриальных AT. Начало ПСХ может напоминать хронический гепатит, особенно у детей, или криптогенный цирроз. Ключом к диагнозу оказывается повышение активности ЩФ; диагноз верифицируют с помощью холангиографии. При наличии в анамнезе операции на желчных путях или выявлении желчных камней следует исключать вторичный склерозирующий холангит, развивающийся вследствие послеоперационных стриктур желчных протоков или холедохолитиаза. При исследовании сыворотки крови выявляются признаки холестаза с повышением активности ЩФ в 3 раза выше нормы. Уровень билирубина значительно колеблется и в редких случаях превышает 10 мг% (170 мкмоль/л). Как у всех больных с холестазом, увеличивается содержание меди в сыворотке крови и церулоплазмина, а также меди в печени. Уровни у-глобулинов и IgM повышаются в 40—50% случаев. В сыворотке могут выявляться низкие титры AT к гладкой мускулатуре и антинуклеарных AT, но антимитохондриальные AT отсутствуют. Изредка наблюдается эозинофилия. Эндоскопическая ретроградная холангиопанкреатикография (ЗРХПГ) — метод выбора, хотя с успехом может быть использована чреспеченочная холангиография. Диагностическим критерием считается выявление участков неравномерного сужения и расширения (четкообразность) внутри внепеченочных желчных путей. Стриктуры имеют небольшую длину(0,5-2 см), вызывают nepежим протоков и чередуются с неизмененными или слегка расширенными участками желчных протоков. По ходу общего желчного протока могут обнаруживаться выпячивания, напоминающие дивертикулы. При холангиографии поражение может ограничиваться только внутрипеченочными, только внепеченочными протоками или даже только одним печеночным протоком. При поражении мелких протоков на холангиограммах изменения отсутствуют. УЗИ выявляет утолщение стенок желчных протоков, при КТ — минимально расширенные участки на протяжении желчных протоков; аналогичная картина наблюдается при редко встречающейся диффузной холангиокарциноме. При наличии в анамнезе операции на желчных путях или выявлении желчных камней следует исключать вторичный склерозирующий холангит, развивающийся вследствие послеоперационных стриктур желчных протоков или холедохолитиаза. Морфологические изменения. При перфузионном исследовании желчных протоков печени, удаленной во время трансплантации, выявляют тубулярное и мешотчатое расширение внутрипеченочных протоков, их трансформацию в фиброзные тяжи вплоть до полного исчезновения. Гистологически портальные зоны инфильтрированы мелкими и крупными лимфоцитами, нейтрофилами, иногда макрофагами и эозинофилами. Вокруг междольковых желчных канальцев выявляют перидуктулярное воспаление, в некоторых случаях сопровождающееся десквамацией эпителия. Внутри долек может отмечаться воспалительная инфильтрация, клетки Купфера набухшие и выступают в просвет синусоидов. Холестаз заметен лишь при выраженной желтухе. Со временем в портальных трактах развивается фиброз, вызывающий образование вокруг мелких протоков пучков соединительной ткани в виде луковичной шелухи. Остатки желчных протоков удается выявить только в виде фиброзных колец. Портальные зоны приобретают звездчатый вид. Гистологические изменения неспецифичны, но уменьшенное количество желчных протоков, пролиферация канальцев и значительные отложения меди наряду со ступенчатыми некрозами позволяют заподозрить ПСХ и служат основанием для проведения холангиграфии. В общем желчном протоке возможны фиброз и воспаление, не имеющие диагностического значения. Течение. Продолжительность жизни при ПСХ с момента постановки диагноза составила в среднем 11,9 года. При наблюдении за больными с бессимптомным течением заболевания в течение 6 лет выявлено его прогрессирование у 70% из них, у трети — с развитием печеночной недостаточности. Хотя некоторые больные могут чувствовать себя удовлетворительно, у большинства прогрессируют холестатическая желтуха и поражение печени, наиболее ярко проявляющееся кровотечением из варикозно расширенных вен пищевода, печеночной недостаточностью и холангиокарциномой. Прогноз при поражении внепеченочных желчных протоков хуже, чем при поражении только внутрипеченочных. Лечение. Специфического лечения ПСХ не существует. Для купирования кожного зуда применяют холестирамин, активированный уголь, фенобарбитал, рифампицин, антагонист опиоидных рецепторов (налоксон), плазмаферез, гемосорбцию. Пациенты с дефицитом жирорастворимых витаминов должны получать заместительную терапию. Эффективного лечения остеопороза не разработано. По мере необходимости корректируют недостаток витаминов, дополнительно применяют кальций, эстрогены (у женщин в постменопаузе). Урсодезоксихолевая кислота (урсосан) — единственный препарат, который в низких (10 мг/кг) и средних (13—15 мг/кг) дозах улучшает биохимические показатели, но не влияет на клиническую картину заболевания, гистологическую картину и сроки выживаемости. При назначении высокой дозы УДХК (20 мг/кг) отмечено снижение уровня щелочной фосфатазы и ГГТП, прекращение гистологической прогрессии. Пероральная пульс-терапия метотрексатом или колхицином неэффективна. Учитывая вариабельность течения и длительные бессимптомные периоды, эффективность лечения клинически оценивать трудно. Холангит следует лечить антибиотиками широкого спектра действия. Антигистаминные препараты используются только благодаря их седативному действию. Фенобарбитал может уменьшить зуд у больных, резистентных к другим видам лечения. Зуд у больных с билиарной обструкцией исчезает или значительно уменьшается после наружного или внутреннего дренирования желчных пугей. Эндоскопическое лечение позволяет расширять стриктуры крупных протоков и удалять мелкие пигментные камни или сгустки желчи. Возможна установка стентов и назобилиарных катетеров. При этом показатели функции печени улучшаются, а результаты холангиографии вариабельны. Смертность невелика. Оперативное лечение, например резекция внепеченочных желчных протоков и их реконструкция с использованием чреспеченочных стентов, нежелательно из-за высокого риска развития холангита. Для лечения бактериального холангита применяют внутривенное введение антибиотиков широкого спектра действия. Часто эффективна профилактика ципрофлоксацином, который достигает высокой концентрации в желчи. Если образуются стриктуры, которые проявляются желтухой, зудом и бактериальным холангитом, то следует проводить эндоскопическую или чрескожную баллонную дилатацию. Часто нужна установка длинных стентов. Во всех случаях с целью исключения холангиокарциномы необходимо цитологическое исследование желчи и соскоба. После трансплантации печени у взрослых 3-летняя выживаемость составила 85%. В желчных протоках пересаженной печени у больных с ПСХ стриктуры в ней развиваются чаше, чем у больных с другими заболеваниями после трансплантации. Причинами этого могут быть ишемия, реакция отторжения и инфекция в области анастомозов желчных путей. Возможны рецидивы заболевания пересаженной печени. | |
|
| |
| Просмотров: 99922 | |
| Всего комментариев: 0 | |