Современное лечение множественной миеломы
| Современные методы диагностики и лечения множественной миеломы Современные методы лечения множественной миеломы МНОЖЕСТВЕННАЯ МИЕЛОМА Множественная миелома (миеломная болезнь, миелома — ММ) — злокачественная лимфопролиферативная опухоль, характеризующаяся пролиферацией одного клона плазматических клеток, продуцирующих электрофоретически и иммунологически гомогенный (моноклональный) протеин. По МКБ-10 С90 Множественная миелома и злокачественные плазмоклеточные новообразования. К злокачественным плазмоклеточным новообразованиям, кроме ММ, характеризующимся пролиферацией плазматических клеток в костном мозге, относятся плазмоцитомы, плазмоклеточные экстрамедулярные образования, локализующиеся чаще в костях или мягких тканях. Эпидемиология. Множественная миелома (ММ) — довольно частое заболевание системы крови, 1% всех онкологических заболеваний и 10% среди онкогематологических. Ежегодно регистрируется 4 новых случая на 100 000 белого населения. Заболевание редко встречается улиц моложе 40 лет. Пик заболеваемости приходится на возраст 65 лет. Среди 80-летних заболеваемость резко возрастает. Мужчины болеют несколько чаще (около 60%), чем женщины. Этиология ММ неизвестна. Патогенез. Патогенез ММ окончательно не ясен. Видимо, под воздействием антигенной стимуляции (инфекции, хронические воспаления) у людей с нестабильным геном происходит транслокация 14q32, в результате чего происходит появление моноклональной доброкачественной гаммапатии (опухоль еще не имеет признаков злокачественности), в дальнейшем в результате изменения микроокружения в строме костного мозга и дополнительных мутаций происходит озлокачествление клона и появление признаков прогрессии. ММ отличается низкой пролиферативной активностью клеток. Миеломные клетки выделяют множество различных цитокинов, таких как ИЛ-6, фактор роста гепатоцитов, металлопротеиназы и другие, способствующие повышению остеокластной активности и подавлению остеобластов. В патогенезе остеодеструктивного синдрома значительную роль играет и активность стромальных клеток костного мозга. Избыток легких цепей у больных с миеломой приводит к формированию амилоидных фибрилл и повышенному отложению их в различных органах (коже, почках). Кроме повышенной экскреции легких цепей факторами, приводящими к нарушению функции почек, являются гиперкальшемия, гиперурикемия, повышенная вязкость крови и рецидивирующая инфекция. Кроме того, может иметь место специфическая инфильтрация почек миеломными клетками. Пролиферация опухолевых клеток в костном мозге ведет к развитию нормохромной, нормоцитарной анемии. Развитие анемии связано как с замещением нормального гемопоэза миеломными клетками, так и с продукцией опухолью факторов, ингибирующих нормальные гемопоэтические клетки (ИЛ-1, ИЛ-6); возможно также развитие иммунной гемолитической анемии вследствие активности парапротеина. На поздних стадиях заболевания могут наблюдаться нейтропения и тромбоцитопения. Развитие кровоточивости у больных с ММ связано обычно с синдромом гипервязкости. Разрушение вследствие остеолитического синдрома поясничных позвонков сопровождается компрессией спинного мозга, корешковыми болями, нарушением функции тазовых органов. Классификация множественной миеломы в зависимости от продукции моноклонального парапротеина: 1) ММ с продукцией одного моноклонального белка (IgG, IgA, IgD, IgE); 2) MM с биклональная с продукцией двух моноклональных парапротеинов; 3) несекретирующая миелома; 4) ММ с секрецией только моноклональной легкой цепи (k или лямбда) — миелома Бенс-Джонса. ММ с секрецией IgG — самая частая форма, встречается в 59% случаев; ММ с секрецией IgA — 21%; IgD — 1%; биклональная — 1%; несекретирующая миелома — в 3% случаев; миелома Бенс-Джонса — в 15% случаев. Стадии ММ (Сальмон и Дьюри). Миелома I стадии — низкая масса опухолевых клеток (НЬ>100 г/л, Ig G<50 г/л, IgA < 30г/л, уровень Са2+ менее 12 мг/дл, отсутствуют клинические и рентгенологические признаки поражения костей, протеинурия менее 4 г/24 ч). Миелома II стадии — средняя масса опухоли (НЬ 85-100 г/л, Ig G 50-70 г/л, IgA 30—50 г/л, уровень Са2+ может быть незначительно повышен, начальные рентгенологические признаки изменения костей). Миелома III стадии — большая масса опухоли (НЬ < 85 г/л, Ig G > 7 г/л, IgA > 5 г/л, уровень Са3+ повышен, более 12 мг/дл, более 3 зон с остеодеструктивными поражениями, протеинурия более 12 г/24 ч). Новая интернациональная система стадирования ММ на основании количества b2-микроглобулина: 1 стадия (средняя продолжительность жизни — 6 лет): низкий уровень b2-микроглобулина (менее 3,5 мг/дл) и уровень альбумина >3,5 г/дл. 2 стадия (продолжительность жизни — 4 года): низкий уровень b-микроглобулина, но уровень альбумина < 3,5 г/дл или B2М — от 3,5 до 5,5. 3 стадия (продолжительность жизни 2 года): высокий уровень B2М - от 5,5 мг/дл и больше. Клиническая картина складывается из сочетания синдромов и симптомов: 1. Симптомы, связанные с парапротеинемией - синдром гипервязкости (чаще ассоциирован с MM IgG3, IgA), утомляемость, спутанность сознания, потеря сознания, застойные явления сосудов сетчатки, кровоизлияния в сетчатку, генерализованный геморрагический диатез при сочетании гипервязкости с коагулопатией; симптомы, связанные с активностью парапротеинов, обладающих свойствами антител, — аутоиммунная гемолитическая анемия, формирование ксантом, гемахроматоз, пигментация, гипотиреоидизм, гипогликемия, амилоидоз. 2. Остеодеструктивный синдром — боли в костях, радикулярные боли; компрессионные переломы; гиперкальииемия (тошнота, полиурия, запоры, жажда, затуманенность сознания). 3. Клинические проявления инфильтрации костного мозга. Анемия при ММ может быть следствием: инфильтрации костного мозга плазматическими клетками, поражения почек, действия иитостатиков, иммунных гемолитических анемий (парапротеин-гемагглютинин(С4) или криоглобулин G), цитокиновых эффектов плазматических клеток (IL6,IL1 ингибируют эритропоэз). Тромбоцитопения и лейкопения чаше ассоциируются с действиями цитостатиков. У некоторых больных ММ выявляется тромбоцитоз как следствие тромбопоэтического эффекта IL6. У больных ММ с остеосклеротическими очагами могут наблюдаться полицитемия и тромбоцитоз. 4. Поражение почек: миеломная нефропатия. Диагностика Методы, применяемые для диагностики ММ: 1. Анализ сывороточного протеина (электрофорез белков сыворотки крови, иммуноэлектрофорез сыворотки крови и мочи для идентификации моноклонального глобулина и субкласса легких цепей, иммунофиксация, нефелометрия, иммуноблотинг). 2. Биопсия костного мозга и аспирационная биопсия. 3. Диагностика поражения костей скелета — рентгенологическое исследование, Я MP, РЭТ. Остеосцинтиграфия не применяется для диагностики очагов остеодеструкции. 4. Диагностика поражения почек. Диагностические критерии миеломы по Дюрьи и Сальмон Большие критерии 1. Плазмоцитома в биоптате тканей. 2. Плазмоцитоз в костном мозге: >30% плазматических клеток 3. Пик моноклональных иммуноглобулинов на электрофорезе сыворотки: — IgG > 35 г/л; — IgA > 20 г/л; — экскрекция легких цепей на электрофорезе мочи > 1 г/24 ч при отсутствии признаков первичного амилоидоза (AL). Сывороточные глобулины k и лямбда более чем 100 мг/л и соотношение k/лямбда > 4,5 или < 0,2 при отсутствии признаков амилоидоза и макроглобулинемии Вальденстрема. Малые критерии A. Плазмоцитоз в костном мозге 10—30% плазматических клеток B. Пик моноклональных глобулинов на более низком уровне C. Очаги расплавления костей Д. Норма IgM <500 мг/л, IgA <10г/л, IgG <60 г/л. Снижение индивидуальной концентрации свободных легких цепей ниже нормы или соотношение k/лямбда > 1,65 или < 0,26. Диагноз миеломы выставляется при наличии как минимум одного большого и одного малого критерия или трех малых критериев, которые должны включать А+В. Диагностические критерии индолентной миеломы (вялотекущей) по Kyle: M-протеин в крови >3 г/дл, плазматические клетки костного мозга >10%, анемии — нет, кальций — норма. Креатинин — норма, литические очаги — нет, индекс пролиферации плазматических клеток — низкий (<G,5%). Об эндолентной миеломе свидетельствует отсутствие признаков прогрессии при длительном наблюдении. Лечение. Терапия солитарной миеломы — оперативное лечение и местная лучевая терапия. Терапия индолентной миеломы — при верификации индолентной «тлеющей» миеломы по международным критериям цитостатическая терапия не показана. У пациентов молодого возраста могут обсуждаться показания к началу индукционной терапии ММ является единственной гемопоэтической опухолью, при которой статистически доказана целесообразность проведения комплексной терапии с аутотрансплантацией костного мозга. Поэтому для выбора правильной терапевтической тактики необходимо решить вопрос показаний и противопоказаний к аутотрансплантации костного мозга. 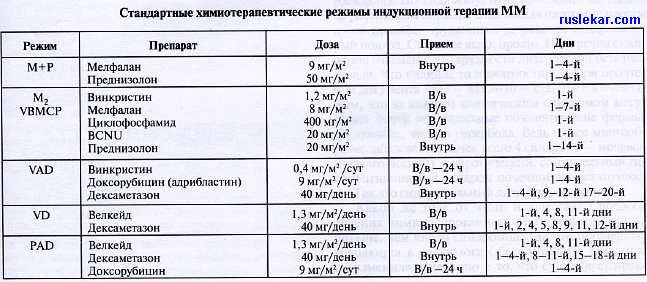 К факторам, влияющим на решение этого вопроса, относятся возраст пациента (до 60-65 лет), наличие сопутствующих заболеваний и согласие больного. Если АТГСК возможна, лечение начинают с индукционной терапии. Возможные схемы индукционной терапии: VAD-D-D, VD (Велькейд 1,3 мг/м2в/в(дни 1,4,8,11) + дексаметазон 20 мг перорально (дни 1,2,4,5,8,9,11,12)), PAD (велькейд, доксорубицин, дексаметазон). Эффективным, но, к сожалению, не зарегистрированным в РФ, является препарат талидомид. Проводят 4 курса индукционной терапии, рестадируют и в случае получения ответа проводят аферез гемопоэтических стволовых клеток крови с последующей высокодозной терапией мелфаланом и трансплантацией. До настоящего времени не решен вопрос: всем ли пациентам или только больным высокого риска показана двойная аутотрансплантация ГСК (гемопоэтических стволовых клеток). Пациентам высокого риска и имеющим родственного донора вторая трансплантация — аллогенная. Режим MP (мелфалан-преднизолон) в качестве индукционной терапии является противопоказанием к проведению АТГСК. Если пациенту не планируют проводить АТГСК, то в качестве индукционной терапии возможно применение любых схем, показанных для лечения ММ. Эффективность протокола MP: полных ремиссий менее 5%, частичных ремиссий 45-55%, 15% больных — прогрессия; PAD: полных ремиссий — 29—57%, частичных ремиссий — 95%; VD: полных ремиссий — 25%, частичных ремиссий — 88%. Введение в терапевтическую практику терапии ММ новых препаратов, таких как талидомид, ревлимид, велькейд, позволяет надеяться на улучшение прогноза и увеличение продолжительности жизни больных ММ. Поддерживающая терапия. Интерферон-а 3 млн ед х 3 раза в нед — минимальное улучшение выживаемости без прогрессии, не влияет на общую выживаемость больных. Преднизолон 20 мг/день х 5 дней - 1 раз в 1—2 мес, доказано увеличение выживаемости без прогрессии, однако увеличивается частота осложнений, связанных с кортикостероидами. Талидомид в качестве монотерапии или в комбинации — увеличение безпрогрессивной выживаемости. Исходы лечения Полная ремиссия (не менее 8 нед): отсутствие М-протеина в моче и сыворотке при определении методом иммуноэлектрофореза и подтвержденное иммунофиксацией; менее 5% плазматических клеток в костном мозге; отсутствие новых очагов остеолиза, уменьшение размеров имеющихся; отсутствие симптомов заболевания и трансфузионной зависимости. Частичная ремиссия (наличие одного и более признаков в течение 8 нед): редукция парапротеина сыворотки на 50%; секреция легких цепей — снижение > 50%, если уровень их в суточной моче был > 1,0 г, или снижение < 0,1 г в суточной моче, если их уровень был 0,5—1,0 г; снижение плазмоцитоза костного мозга > 50%. Фаза плато (показатели сохраняются в течение 6 мес): стабилизация показателей М-протеина в сыворотке и секреции легких цепей в моче; стабильная рентгенологическая картина (отсутствие новых очагов деструкции и увеличение размеров имеющихся); стабильные показатели уровня кальция сыворотки; стабильные гематологические показатели (гемоглобин, лейкоциты, тромбоциты); стабильная клиническая симптоматика, отсутствие трансфузионной зависимости. Прогрессирование заболевания: повышение > 25% сывороточного парапротеина; повышение >50% уровня легких цепей в суточной моче; > 5% плазматических клеток; развитие гиперкальциемии у больных с ранее нормальным уровнем кальция; появление новых остеологических очагов или увеличение > 50% размеров имеющихся. Прогноз Больные с I стадией без признаков прогрессии (эндолентная миелома) могут многие годы жить без какого-либо лечения. При развитии III стадии миеломы средняя продолжительность жизни больных 2-3 года. Введение в практику мегадозной терапии и трансплантации стволовых кроветворных клеток увеличивает продолжительность жизни больных. При сравнении эффективности терапии с одной АТГСК по сравнению со стандартной терапией по протоколу C-VAMP — достижение полной ремиссии в 44% по сравнению с 8%, медиана безрецидивной выживаемости 32 месяца по сравнению с 22. При сравнении эффективности двойной трансплантации ГСК по сравнению с одной показано увеличение 7-летней общей выживаемости (42/21%). Профилактика. Эффективной профилактики миеломной болезни не существует. | |
|
| |
| Просмотров: 22829 | |
| Всего комментариев: 0 | |